Principes physico-chimiques à connaitre en lien avec le verre
Introduction
Les notions que vous allez aborder dans ce chapitre, sont essentielles à la compréhension des chapitres suivants sur l'élaboration et la mise en œuvre du verre.
Il vous aidera notamment à comprendre l'influence des facteurs physiques et chimiques dans le travail du verre en atelier.
1. Les différents états de la matière
Les états de la matière
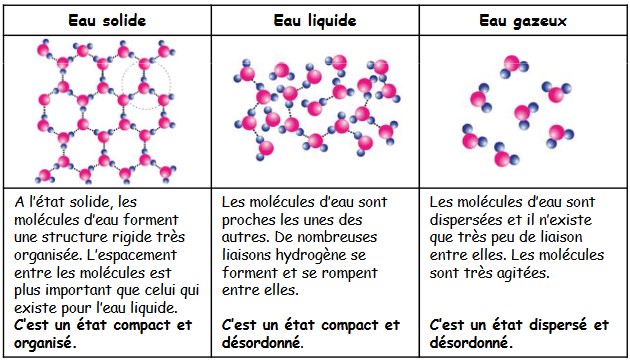
Définition : En physique, un état de la matière est une des quatre formes ordinaires que peut prendre toute substance dans la nature, soit au sens strict : solide, liquide, gaz et plasma.
source Wikipédia : états de la matière
source : c'est pas sorcier
Exemple : à pression constante, l’eau est
- Solide au dessous de 0°C
- Liquide entre 0 et 100°C
- Gazeuse au dessus de 100°C

Les changements d'états :
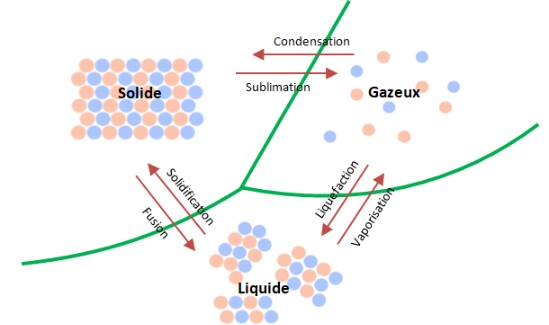
Pourquoi la matière change-t-elle d’état ?
Partant d'un liquide, si la température augmente, les molécules vont s’agiter fortement (on obtient un gaz). Si la température baisse,
elles vont s’attacher solidement les unes aux autres et donner un solide.
La pression joue également un rôle important.
En général, lorsque la matière se solidifie, les molécules, qui ont perdu leur mouvement, se disposent régulièrement:
- On obtient un corps cristallin.
- Si ce n’est pas le cas, on obtient un corps vitreux comme le verre.
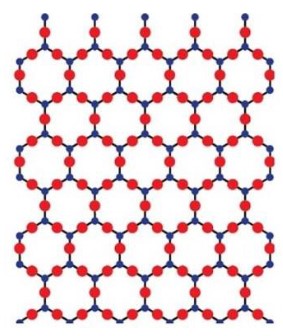
Les atomes sont organisés de façon "ordonnée", c'est un matériau cristallin.
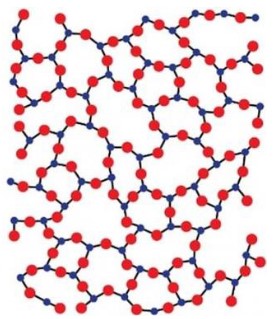
Les atomes sont agencés de façon "désordonnée", c'est un matériau amorphe.
Corps vitreux:
A
l'état solide, contrairement aux corps cristallisés, un corps vitreux
est composé d’atomes ou molécules qui sont "désordonnés".
Les corps vitreux passent graduellement de l’état liquide à l’état solide, de manière continue.
voir plus loin au chapitre : "Mon verre est amorphe !"